Кристаллические решетки в химии
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
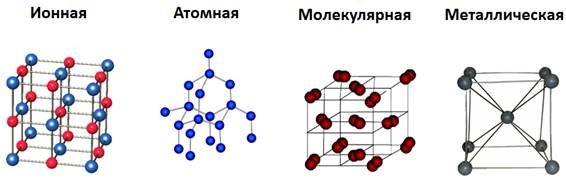
В зависимости от частиц кристаллической решетки существует четырнадцать типов оной, приведем наиболее популярные из них:
- Ионная кристаллическая решетка.
- Атомная кристаллическая решетка.
- Молекулярная кристаллическая решетка.
- Металлическая кристаллическая решетка.
Далее более подробно опишем все типы кристаллической решетки.
Строение металлов. Атомно-кристаллическое строение металлов.
Данные свойства обусловлены особенностями строения металлов. Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны. На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов.
Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Изготовление: 3600 штрихов на миллиметр
Сегодня дифракционную решетку можно сделать самому из более современных материалов, например DVD-диска. Шаг между штрихами такой решетки составляет 0,74 мкм. Это намного более впечатляющий результат по сравнению с самой первой искусственной дифракционной решеткой в мире, которая появилась в 1875 году: она состояла из 50 натянутых волосков с расстоянием между ними в 250 мкм.
Число штрихов современной дифракционной решетки может доходить до 3600 на один миллиметр, и процесс изготовления такого устройства требует очень высокой точности. Если хоть одна щель из множества будет нанесена с ошибкой, то решетка будет забракована. Нарезание решетки длится до 7 суток, хотя время нанесения штриха составляет 3 секунды.

Существуют два вида дифракционных решеток: прозрачные и отражательные. Прозрачная решетка – это стеклянная тонкая пластинка или пластинка из прозрачного пластика, на которую нанесены штрихи. Штрихи дифракционной решетки являются препятствием для света, через них он не может пройти. Оставшиеся между штрихами прозрачные зазоры играют роль щелей. При выполнении лабораторных работ чаще используют этот вид решеток.
Отражательная решетка – это металлическая или пластиковая отполированная пластинка, на которую вместо штрихов нанесены бороздки определенной глубины. Такие решетки часто используют при анализе спектров излучения. Вышеупомянутый DVD-диск – яркий пример этого вида дифракционной решетки: расположив его перед глазом, можно найти на нем спектр.
1.3.3. Вещества молекулярного и немолекулярного строения. Тип кристаллической решётки. Зависимость свойств веществ от их состава и строения.
Для большинства веществ характерна способность в зависимости от условий находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном.
Например, вода при нормальном давлении в интервале температур 0-100 o C является жидкостью, при температуре выше 100 о С способна существовать только в газообразном состоянии, а при температуре менее 0 о С представляет собой твердое вещество.
Вещества в твердом состоянии различают аморфные и кристаллические.
Характерными признаками аморфных веществ является отсутствие четкой температуры плавления: их текучесть плавно увеличивается с ростом температуры. К аморфным веществам относятся такие соединения, как воск, парафин, большинство пластмасс, стекло и т.д.
Все же кристаллические вещества обладают конкретной температурой плавления, т.е. вещество с кристаллическим строением переходит из твердого состоянии в жидкое не постепенно, а резко, при достижении конкретной температуры. В качестве примера кристаллических веществ можно привести поваренную соль, сахар, лед.
Разница в физических свойствах аморфных и кристаллических твердых веществ обусловлена прежде всего особенностями строения таких веществ. В чем заключается разница между веществом в аморфном и кристаллическом состоянии, проще всего понять из следующей иллюстрации:
Как можно заметить, в аморфном веществе, в отличие от кристаллического, отсутствует какой-либо порядок в расположении частиц. Если же в кристаллическом веществе мысленно соединить прямой два близкорасположенных друг к другу атома, то можно обнаружить, что на этой линии на строго определенных промежутках будут лежать одни и те же частицы:
Таким образом, в случае кристаллических веществах можно говорить о таком понятии, как кристаллическая решетка.
Кристаллической решеткой называют пространственный каркас, соединяющий точки пространства, в которых находятся частицы, образующие кристалл.
Точки пространства, в которых находятся образующие кристалл частицы, называют узлами кристаллической решетки.
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают: молекулярную, атомную, ионную и металлическую кристаллические решетки.
В узлах молекулярной кристаллической решетки
находятся молекулы, внутри которых атомы связаны прочными ковалентными связями, однако сами молекулы удерживаются друг возле друга слабыми межмолекулярными силами. Вследствие таких слабых межмолекулярных взаимодействий кристаллы с молекулярной решеткой являются непрочными. Такие вещества от веществ с иными типами строения отличаются существенно более низкими температурами плавления и кипения, не проводят электрический ток, могут как растворяться, так и не растворяться в различных растворителях. Растворы таких соединений могут как проводить, так и не проводить электрический ток в зависимости от класса соединения. К соединениям с молекулярной кристаллической решеткой относятся многие простые вещества — неметаллы (отвержденные H2, O2, Cl2, ромбическая сера S8, белый фосфор P4), а также многие сложные вещества – водородные соединения неметаллов, кислоты, оксиды неметаллов, большинство органических веществ. Следует отметить, что, если вещество находится в газообразном или жидком состоянии, говорить о молекулярной кристаллической решетке неуместно: корректнее использовать термин — молекулярный тип строения.
Кристаллическая решетка алмаза как пример атомной решетки
В узлах атомной кристаллической решетки
находятся атомы. При этом все узлы такой кристаллической решетки «сшиты» между собой посредством прочных ковалентных связей в единый кристалл. Фактически, такой кристалл является одной гигантской молекулой. Вследствие особенностей строения все вещества с атомной кристаллической решеткой являются твердыми, обладают высокими температурами плавления, химически мало активны, не растворимы ни в воде, ни в органических растворителях, а их расплавы не проводят электрический ток. Следует запомнить, что к веществам с атомным типом строения из простых веществ относятся бор B, углерод C (алмаз и графит), кремний Si, из сложных веществ — диоксид кремния SiO2 (кварц), карбид кремния SiC, нитрид бора BN.
У веществ с ионной кристаллической решеткой
в узлах решетки находятся ионы, связанные друг с другом посредством ионных связей.
Поскольку ионные связи достаточно прочны, вещества с ионной решеткой обладают сравнительно высокой твердостью и тугоплавкостью. Чаще всего они растворимы в воде, а их растворы, как и расплавы проводят электрический ток.
К веществам с ионным типом кристаллической решетки относятся соли металлов и аммония (NH4 + ), основания, оксиды металлов. Верным признаком ионного строения вещества является наличие в его составе одновременно атомов типичного металла и неметалла.
 Кристаллическая решетка хлорида натрия как пример ионной решетки
Кристаллическая решетка хлорида натрия как пример ионной решетки
Однако следует отметить, что в веществах с ионным типом строения нередко можно обнаружить, помимо ионных, также ковалентные полярные связи. Это наблюдается в случае сложных ионов, т.е. состоящих из двух или более химических элементов (SO4 2- , NH4 + , PO4 3- и т.д.). Внутри таких сложных ионов атомы связаны друг с другом ковалентными связями.
Металлическая кристаллическая решетка
наблюдается в кристаллах свободных металлов, например, натрия Na, железа Fe, магния Mg и т.д. В случае металлической кристаллической решетки, в ее узлах находятся катионы и атомы металлов, между которыми движутся электроны. При этом движущиеся электроны периодически присоединяются к катионам, таким образом нейтрализуя их заряд, а отдельные нейтральные атомы металлов взамен «отпускают» часть своих электронов, превращаясь, в свою очередь, в катионы. Фактически, «свободные» электроны принадлежат не отдельным атомам, а всему кристаллу.
Металлическая кристаллическая решетка
Такие особенности строения приводят к тому, что металлы хорошо проводят тепло и электрический ток, часто обладают высокой пластичностью (ковкостью).
Разброс значений температур плавления металлов очень велик. Так, например, температура плавления ртути составляет примерно минус 39 о С (жидкая в обычных условиях), а вольфрама — 3422 °C. Следует отметить, что в обычных условиях все металлы, кроме ртути, являются твердыми веществами.
Молекулярная связь кристаллических решеток.
Основная особенность межмолекулярной связи заключается в ее «слабости» (ван-дер-ваальсовые, водородные).

Это структура льда. Каждая молекула воды связана водородными связями с 4-мя окружающими ее молекулами, в результате структура имеет тетраэдрический характер.
Водородная связь объясняет высокую температуру кипения, плавления и малую плотность;
Виды химической связи
Ионная химическая связь
Ионная связь — очень прочная химическая связь, образующаяся между атомами с большой разностьюэлектроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью.
Результатом этого является образование соединения противоположно заряженных ионов:
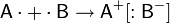
Это притяжение ионов как разноимённо заряженных тел. Ионная связь — крайний случай поляризации ковалентной полярной связи.
Образуется между типичными металлом и неметаллом (Me + неМе).
При этом электроны у металла полностью переходят к неметаллу, образуются ионы (частицы, имеющие заряд).
Например, типичные металлы литий (Li), натрий (Na), калий (K), кальций (Ca), стронций (Sr), барий (Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия (NaOH) и сульфате натрия (Na2SO4) ионные связи существуют только между атомами натрия и кислорода (остальные связи — ковалентные полярные).
Ковалентная химическая связь
Ковалентная полярная химическая связь образуется при взаимодействии атомов, значение электроотрицательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому.
Электроотрицательность (ЭО) — способность атома химических элемента смещать к себе общие электронные пары, участвующие в образовании химической связи.
Ковалентная полярная связь образуется между разными неметаллами (неМе + неMe).
Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
Такая связь существует в молекулах следующих сложных веществ: Н2О, H2S, NH3 и др.
К ковалентным связям в полной мере относятся и те связи, которые образованы по донорно-акцепторному механизму, например в ионах гидроксония (Н3О+) и аммония (NH4+).
Металлическая химическая связь
Связь в металлах и сплавах между атом-ионами посредством обобществленных электронов называется металлической.
Металлическая связь — химическая связь, которая обусловлена взаимодействием положительных ионов металлов, составляющих кристаллическую решётку, с электронным газом из валентных электронов.
Металлическая химическая связь образуется в простых веществах-металлах (Me).
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь, т.е. электроны как бы цементируют положительные ионы кристаллической решетки металлов.
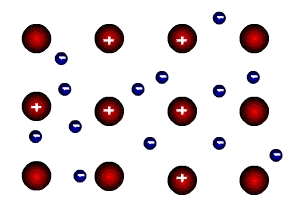 Металлическая кристаллическая решетка
Металлическая кристаллическая решетка
Металлическая связь существует в металлах в твердом в жидком состоянии. В соответствии с положением в периодической системе атомы металлов имеют небольшое число валентных электронов (1-3 электрона) и низкую энергию ионизации (отрыва электрона). Поэтому валентные электроны слабо удерживаются в атоме, легко отрываются и имеют возможность перемещаться по всему кристаллу.
В узлах кристаллической решетки металлов находятся свободные атомы, положительно заряженные ионы, а часть валентных электронов, свободно перемещаясь в объеме кристаллической решетки, образует «электронный газ» , обеспечивающий связь между атомами металла.
Связь, которую осуществляют относительно свободные электроны между ионами металлов в кристаллической решетке, называется металлической связью.
Металлическая связь возникает за счет обобществления атомами валентных электронов. Однако между этими видами связи есть существенное различие. Электроны, осуществляющие ковалентную связь, в основном пребывают в непосредственной близости от двух соединенных атомов.
В случае металлической связи электроны, осуществляющие связь, перемещаются по всему куску металла. Этим определяются общие признаки металлов: металлический блеск, хорошая проводимость теплоты и электричества, ковкость, пластичность и т. д.
Общим химическим свойством металлов является их относительно высокая восстановительная способность.
Состав кристаллической решетки
Итак, еще из школьного курса химии и физики нам известно, что абсолютно все вещества состоят из мелких частиц, которые связаны между собой. И вот именно от силы связей зависит то, в каком агрегатном состоянии находится тело: твердое, жидкое или газообразное. Когда частицы имеют строгую ориентацию в пространстве, то они формируют твердое тело. Все твердые тела имеют четкие контуры из-за четкой структуры их мелких частей. Что же касается мелких частиц, то, несмотря на свое строгое место в пространстве, они все равно продолжают двигаться. Скорость и амплитуда такого движения напрямую зависит от температуры: если она ниже нуля, то скорость падает и образуется твердое тело, что касается высоких температур, то в таком случае будут образовываться газообразные и жидкие тела, а частицы будут просто быстро двигаться и перемещаться.
Остановимся все же на организации твердых тел. Когда частицы (атомы, молекулы или ионы) точно определены с местом в пространстве, то таким образом обязуется кристаллическая решетка. Частицы могут располагаться как между узлами в пространстве, так и непосредственно в узлах. Молекулярная, атомная, металлическая и ионная – эти четыре типа решеток существуют в природе. Разница между решетками сводится до частиц, которые находятся в узлах и связях, протекающих между ними.
Виды химической связи: ковалентная (полярная и неполярная), ионная
Ковалентной связью называется химическая связь между двумя атомами за счет образования общей электронной пары. Ковалентная связь может быть неполярной — между двумя атомами с одинаковой электроотрицательностью, т. е. в простых веществах, и полярной — между атомами, электроотрицательность которых различается, т. е. в сложных веществах.
Рассмотреть образование ковалентной неполярной связи удобно на примере молекулы водорода, образующейся при соединении двух атомов водорода, каждый из которых имеет по одному неспаренному электрону:
При этом внешняя электронная оболочка получает недостающий электрон, становится завершенной.
Такое состояние характеризуется меньшей энергией, более устойчиво. Вот почему для разрыва ковалентной связи требуется затратить энергию (такое же количество энергии выделяется при ее образовании).
В структурных формулах ковалентная связь изображается черточкой, тогда молекула водорода будет выглядеть так: H–H
Еще раз обращаем Ваше внимание, что ковалентной называется двухэлектронная двухцентровая связь, когда два электрона находятся на общей орбитали двух атомов. Поэтому к ней, строго говоря, не относятся случаи, когда электроны находятся на орбиталях трех или более атомов или когда общая связь образована более чем двумя электронами (в 10–11 классах будет изучаться бензол, в молекуле которого 6 электронов образуют одну общую связь).
Ковалентная полярная связь образуется в молекуле хлороводорода:
.. ..
H· + ·Cl: → H :Cl:
·· ··
Хлор как более электроотрицательный элемент смещает к себе общую электронную пару, в результате на нем образуется частичный отрицательный заряд, а на водороде — частичный положительный:
Ковалентная связь может возникать не только при объединении двух орбиталей, содержащих по одному неспаренному электрону. Один атом может предоставить электронную пару, а второй — свободную орбиталь. Такая ковалентная связь называется донорно-акцепторной.
Например, в ионе аммония протон присоединяется к молекуле аммиака за счет образования донорно-акцепторной связи. Азот выступает донором, а протон (водород) — акцептором электронной пары:
Хотя по способу образования донорно-акцепторная связь отличается от остальных, но по свойствам, в том числе по длине связи, все четыре связи одинаковы.
Чтобы подчеркнуть способ образования, донорно-акцепторную связь могут обозначать в структурных формулах стрелкой:
H
|
[H — N → H ] +
|
H
Стрелку используют и чтобы изобразить смещение общей электронной пары в полярной связи (H→Cl), поэтому эти два случая не следует путать.
Ионную связь можно рассматривать как крайний случай ковалентной полярной связи, когда электроны практически полностью переходят от одних атомов к другим с образованием ионов.
Таким образом, ионная связь образуется за счет сил электростатического притяжения между ионами (притягиваются противоположные заряды).
Примером ионной связи будет хлорид натрия:
..
Na + [:Cl:] −
··
Ионная связь характерна для соединений элементов, электроотрицательности которых различаются очень сильно, например щелочных металлов с галогенами.
Сходство с ковалентной связью заключается в том, что сложно провести резкую грань между ковалентной полярной и ионной связью, мнения разных авторов на этот счет могут различаться.
Различие ионной и ковалентной связи в том, что ионная сильнее поляризована, вплоть до полного перехода электронной пары к более электроотрицательному элементу.
Типы кристаллических решеток
- Ионная — в узлах кристаллической решетки расположены положительные и отрицательные ионы. Характерна для веществ с ионной связью: соединений галогенов с щелочными металлами (NaCl), щелочей (NaOH) и солей кислородсодержащих кислот (Na2SO4).
- Атомная — в узлах кристаллической решетки атомы, связанные ковалентными связями: алмаз, кремний.
Вещества с ионными и атомными кристаллическими решетками обладают высокими твердостью и температурой плавления.
2. Опыт. Получение и собирание аммиака
Для получения и собирания аммиака в лаборатории насыпаем в пробирку хлорид или сульфат аммония, смешанный с известью Ca(OH)2, затыкаем пробкой с газоотводной трубкой. Трубку вставляем в колбу, перевернутую вверх дном, — аммиак легче воздуха. Отверстие колбы закрываем куском ваты.
Осторожно нагреваем пробирку на спиртовке. Уравнение реакции:
Аммиак обнаруживаем по характерному резкому запаху (нюхать осторожно!) или поднеся к трубке бумажку, смоченную раствором фенолфталеина (ф-ф). Бумажка розовеет вследствие образования гидроксид-ионов:
NH3 + HOH  NH4 + + OH −
NH4 + + OH −
ПРИМЕНЕНИЕ

Кольцо из железа
Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического производства.
Железо является основным компонентом сталей и чугунов — важнейших конструкционных материалов.
Железо может входить в состав сплавов на основе других металлов — например, никелевых.
Магнитная окись железа (магнетит) — важный материал в производстве устройств долговременной компьютерной памяти: жёстких дисков, дискет и т. п.
Ультрадисперсный порошок магнетита используется во многих чёрно-белых лазерных принтерах в смеси с полимерными гранулами в качестве тонера. Здесь одновременно используется чёрный цвет магнетита и его способность прилипать к намагниченному валику переноса.
Уникальные ферромагнитные свойства ряда сплавов на основе железа способствуют их широкому применению в электротехнике для магнитопроводов трансформаторов и электродвигателей.
Хлорид железа(III) (хлорное железо) используется в радиолюбительской практике для травления печатных плат.
Семиводный сульфат железа (железный купорос) в смеси с медным купоросом используется для борьбы с вредными грибками в садоводстве и строительстве.
Железо применяется в качестве анода в железо-никелевых аккумуляторах, железо-воздушных аккумуляторах.
Водные растворы хлоридов двухвалентного и трёхвалентного железа, а также его сульфатов используются в качестве коагулянтов в процессах очистки природных и сточных вод на водоподготовке промышленных предприятий.



